8 класс онлайн: Химия Габриелян Контрольная 4 с ответами по теме «Растворение. Растворы. Реакции ионного обмена» (по учебнику 2013 года издания), варианты 1 и 2.
Вернуться к Списку контрольных (в ОГЛАВЛЕНИЕ)
Химия 8 класс (Габриелян)
Контрольная работа № 4
К-4 ВАРИАНТ 1
№ 1. Предложите не менее трех классификаций предложенных веществ: Na2CO3, Са(ОН)2, HF, H2O, Fe(OH)2, H2SO4.
ОТВЕТ:
а) электролиты: Na2CO3, Са(ОН)2, HF, H2SO4 и неэлектролиты: H2O, Fe(OH)2,
б) основания: Са(ОН)2, Fe(OH)2, кислоты: HF, H2SO4, соли: Na2CO3,
в) растворимые: Na2CO3, HF, H2SO4, малорастворимые: Са(ОН)2, практически нерастворимые: Fe(OH)2,
— Что положено в основу каждой классификации?
ОТВЕТ: электролиты можно разделить на сильные и слабые.
— Напишите уравнения диссоциации выделенных веществ.
ОТВЕТ:
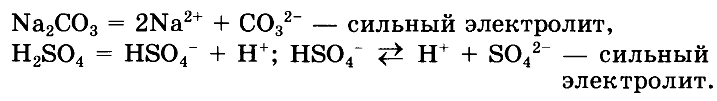
№ 2. Закончите схемы возможных реакций, приведите для них молекулярные, полные и сокращенные ионные уравнения: а) KNO3 + НСl —> ; б) NaOH + ZnCl2 —> ; в) CuI2 + AgNO3 —> ; г) г) Al2(SO4)3 + КВr —> ; д) Mg(OH)2 + H2SO4 —>; e) MnCl2 + Ba(OH)2 —> .
ОТВЕТЫ:
а) KNO3 + HCl = \ \ не до конца идут
б) 2NaOH + ZnCl2 = 2NaCl + Zn(OH)2↓
полное ионное уравнение 2Na+ + 2OH– + Zn2+ + 2Cl– = 2Na+ + 2Cl– + Zn(OH)2↓
сокращ. ионное уравнение Zn2+ + 2OH– = Zn(OH)2↓
в) Cul2 + 2AgNO3 = Cu(NO3)2 + 2Agl↓
Cu2+ + 2l– + 2Ag+ + 2NO3– = Cu2+ + 2NO3– + 2Agl↓
Ag+ + l– = Agl↓
г) Al2(SO4)3 + KBr = \ \ не до конца идут
д) Mg(OH)2↓ + H2SO4 = MgSO4 + 2H2O
Mg(OH)2↓ + 2H+ + SO42– = Mg2+ + SO42– + 2H2O
Mg(OH)2↓ + 2H+ = Mg2+ + 2H2O
е) MnCl2 + Ba(OH)2 = Mn(OH)2 + BaCl2;
Mn2+ + 2OH– = Mn(OH)2.
№ 3. С какими из перечисленных веществ будет взаимодействовать сульфат железа (II): соляная кислота, гидроксид лития, карбонат натрия, ртуть, хлорид бария, магний, гидроксид цинка? Приведите молекулярные и ионные уравнения реакций.
ОТВЕТ:
FeSO4 + 2LiOH = Fe(OH)2 + Li2SO4; Fe2+ + 2OH– = Fe(OH)2;
FeSO4 + Na2CO3 = FeCO3 + Na2SO4, Fe2+ + CO32– = FeCO3;
FeSO4 + BaCl2 = BaSO4 + FeCl2, SO42– + Ba2+ = BaSO4;
FeSO4 + Mg = Fe + MgSO4, Fe2+ + Mg0 = Fe0 + Mg2+.
№ 4. * Покажите генетическую взаимосвязь основных классов неорганических веществ на примере какого-либо металла и его соединений в соответствии со схемой:
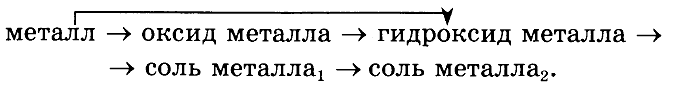
Укажите тип каждой реакции.
ОТВЕТ: Например,
2Са + O2 = 2СаО (соединения);
СaО + H2O = Сa(ОН)2 (соединения);
Сa(ОН)2 + 2НС1 = СаСl2 + H2O (обмена);
СаСl2 + Na2CO3 = СаСO3 + 2NaCl (обмена).
№ 5. Какой объем (н.у.) углекислого газа может быть получен из 12 кг природного известняка, содержащего 80% карбоната кальция?
ОТВЕТ: 2,1504 м3.
№ 6. * Какая масса 10%-ного раствора азотной кислоты потребуется для полной нейтрализации 350 г 3,7%-ного раствора гидроксида кальция?
ОТВЕТ: 220,5 г.
К-4 ВАРИАНТ 2
№ 1. Предложите не менее трех классификаций предложенных веществ: Ва(ОН)2, H2SiO3, FeCl3, Н3РO4, СН3ОН, Al2(SO4)3.
ОТВЕТ: а) электролиты: Ва(ОН)2, FeCl3, H3PO4, Al2(SO4)3 и неэлектролиты: H2SiO3, СН3ОН,
б) основания: Ва(ОН)2, кислоты: H2SiO3, Н3РO4, соли: FeCl3, A12(SO4)3,
в) растворимые: Ва(ОН)2, FeCl3, Н3РO4, СН3ОН, A12(SO4), практически нерастворимые: H2SiO3,
— Что положено в основу каждой классификации?
ОТВЕТ: электролиты можно разделить на сильные и слабые.
— Напишите уравнения диссоциации выделенных веществ.
ОТВЕТ:
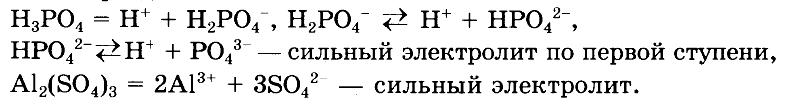
№ 2. Закончите схемы возможных реакций, приведите для них молекулярные, полные и сокращенные ионные уравнения: а) AgNO3 + КСl —> ; б) LiOH + ВаСl2 —> ; в) CuSO4 + Ва(ОН)2 —> ; г) Al2(SO4)3 + КОН —> ; д) Fe(OH)3 + НСl —> ; е) MgCO3 + H2SO4 —> .
ОТВЕТЫ:
a) AgNO3 + КС1 = KNO3 + AgCl (осадок),
полное ионное уравнение K+ + Cl– + Ag+ + NO3– = K+ + NO3– + AgCl
сокращ. ионное уравнение Ag+ + Cl– = AgCl;
б) взаимодействие гидроксида лития с хлоридом бария — реакция не пойдет, т.к. в результате не будет ни осадка, ни газа, ни малодиссоциирующего вещества;
в) CuSO4 + Ba(OH)2 = BaSO4↓ + Cu(OH)2↓;
Cu2+ + SO42– + Ba2+ + 2ОH– = BaSO4↓ + Cu(OH)2↓ ;
r) A12(SO4)3 + 6KOH = 2A1(OH)3↓ + 3K2SO4,
2Al³⁺ + 3SO4²⁻ + 6K⁺ + 6OH⁻ = 2Al(OH)3↓ + 6K⁺ + 3SO4²⁻ ;
Al3+ + 3ОН– = Al(OH)3↓ ;
д) Fe(OH)3 + 3HC1 = FeCl3 + 3H2O,
Fe³⁺ + 3OH⁻ + 3H⁺ + 3Cl⁻ = Fe³⁺ + 3Cl⁻ + 3H2O;
Fe(OH)3 + 3H+ = Fe3+ + 3H2O;
е) MgCO3 + H2SO4 = MgSO4 + CO2↑ + H2O,
MgCO3 + 2H⁺ + SO4²⁻ = Mg²⁺ + SO4²⁻ + H2O + CO2↑;
MgCO3 + 2H+ = Mg2+ + CO2↑ + H2O.
№ 3. С какими из перечисленных веществ будет взаимодействовать соляная кислота: оксид серы (IV), железо, гидроксид хрома (II), серебро, оксид магния, нитрат серебра, сульфат калия? Приведите молекулярные и ионные уравнения реакций.
ОТВЕТ:
2HC1 + Fe = FeCl2 + H2, Fe0 + 2H+ = Fe2+ + H20;
Cr(OH)2 + 2HC1 = CrCl2 + 2H2O, Cr(OH)2 + 2H+ = Cr2+ + 2H2O;
MgO + 2HC1 = MgCl2 + H2O, MgO + 2H+ = Mg2+ + H2O;
AgNO3 + HC1 = AgCl + HNO3, Ag+ + Сl– = AgCl.
№ 4. * Покажите генетическую взаимосвязь основных классов неорганических веществ на примере какого-либо неметалла и его соединений в соответствии со схемой:

Укажите тип каждой реакции.
ОТВЕТ: Например,
С + O2 = CO2 (соединения);
CO2 + H2O = H2CO3 (соединения);
CO2 + 2NaOH = Na2CO3 + H2O;
Na2CO3 + CaCl2 = CaCO3 + 2NaCl (обмена).
№ 5. * Определите массовую долю фосфорной кислоты в растворе, полученном в результате растворения 42,6 г оксида фосфора (V) в 200 г воды.
ОТВЕТ: 24,24%.
№ 6. Какую массу известняка, содержащего 90% карбоната кальция, следует разложить, чтобы получить 2,8 л (н.у.) оксида углерода (IV)?
ОТВЕТ: 13,9 г.
Вы смотрели: 8 класс Химия Габриелян Контрольная 4 по теме «Растворение. Растворы. Реакции ионного обмена» (по учебнику 2013 года издания). Проверяемые темы учебника: Физические явления в химии. Химические реакции. Химические уравнения. Расчёты по химическим уравнениям. Реакции разложения. Реакции соединения. Реакции замещения. Реакции обмена. Типы химических реакций на примере свойств воды.
Вернуться к Списку контрольных (в ОГЛАВЛЕНИЕ)